心輸出量測量儀(Cardiac Output Monitor)百科知識
定義
用于實時測量心臟每分鐘泵血量(CO = 心率×每搏輸出量) 的核心血流動力學設備,是評估心功能、指導液體治療及危重癥搶救的關鍵工具。正常成人靜息心輸出量范圍:4~8 L/min。
一、測量原理與技術分類
根據侵入性程度和原理差異分為四大類:
| 類型 | 代表技術 | 原理 | 精度 | 適用場景 |
|---|---|---|---|---|
| 有創金標準 | 肺動脈導管熱稀釋法(PAC) | 冰鹽水注入右心房,下游肺動脈導管測溫,計算溫度-時間曲線下面積 | ★★★★★ | ICU心臟術后、心源性休克 |
| 微創(動脈波形分析) | PiCCO?/FloTrac? | 動脈置管采集波形,算法分析收縮期曲線下面積(SV)及波形變異度(SVV) | ★★★★☆ | 術中管理、膿毒癥 |
| 無創 | 超聲多普勒(經食道/經胸) | 超聲波探測主動脈血流速度×截面積×心率 | ★★★★☆ | 急診評估、圍術期 |
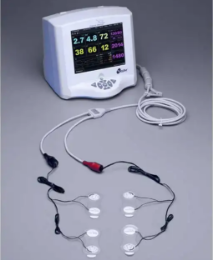
| 完全無接觸 | 生物阻抗法(NICOM?) | 胸部電極片發射高頻電流,監測血流量變化引起的胸腔阻抗波動 | ★★★☆☆ | 透析患者、慢性心衰隨訪 |
注:
熱稀釋法仍是臨床金標準,但操作復雜且并發癥風險高(氣胸、感染);
FloTrac等微創技術依賴動脈壓波形,在低外周阻力(膿毒癥)或心律失常時準確性下降;
食道多普勒(TEE) 需麻醉配合,經胸超聲(TTE) 受操作者技術影響大。
二、核心衍生參數及臨床意義
除心輸出量(CO)外,關鍵衍生參數包括:
| 參數 | 計算公式/原理 | 臨床決策價值 |
|---|---|---|
| 心臟指數(CI) | CO / 體表面積(BSA) | 消除個體大小差異,評估心功能(正常2.5-4.0 L/min/m2) |
| 每搏量(SV) | CO / 心率 | 反映單次心臟泵血效率(正常60-100 ml) |
| 全身血管阻力(SVR) | (平均動脈壓-中心靜脈壓) / CO × 80 | 量化血管收縮狀態(正常800-1200 dyn·s/cm?) |
| 液體反應性指標 | 每搏量變異度(SVV) / 脈壓變異度(PPV) | 預測擴容能否提升CO(SVV>13%提示容量反應陽性) |
關鍵應用:指導休克分型(低血容量性 vs 心源性 vs 分布性)、優化心臟術后血流動力學、精準液體復蘇。
三、設備技術對比(代表性機型)
| 品牌/型號 | 技術路線 | 核心優勢 | 局限 |
|---|---|---|---|
| 愛德華 Lifesciences PAC | 熱稀釋法 | 金標準、可測肺動脈壓/混合靜脈血氧飽和度 | 需X光定位、并發癥率5-10% |
| Getinge PiCCO? | 脈搏輪廓分析 | 微創(僅需動脈+中心靜脈置管)、實時CI/SVV | 需定期熱稀釋校準 |
| Cheetah NICOM? | 生物阻抗法 | 無創、連續監測、移動患者適用 | 胸水/肺水腫患者準確性下降 |
| USCOM 1A? | 經胸超聲多普勒 | 無創、5分鐘快速評估 | 操作者依賴性強 |
四、操作規范與風險防控
有創操作并發癥:
PAC:肺動脈破裂(0.1%)、導管相關感染(1-5%);
動脈置管:血栓形成、肢體缺血。
無創設備誤差源:
生物阻抗法:肥胖、金屬植入物干擾;
多普勒法:聲窗不佳、血管位置變異。
質控要求:
熱稀釋法需重復3次測量取均值;
脈搏輪廓分析每8小時需熱稀釋校準。
五、前沿技術趨勢
AI驅動預測
機器學習分析波形預測低心排風險(如術后2小時預警)。
多模態融合
聯合超聲+動脈波形(如VolumeView?)提升液體反應性評估精度。
可穿戴化
胸帶式阻抗儀(ICG?)實現家庭心功能監測。
術中磁共振兼容
抗磁材料導管(如MRI-Swan?)支持術中實時監測。
臨床價值總結
心輸出量測量儀是血流動力學管理的“眼睛”:
診斷層面 → 精準識別休克類型、量化心衰嚴重度;
治療層面 → 指導強心/升壓藥滴定、液體復蘇終點判定;
預后層面 → 低CI(<2.2 L/min/m2)預示心源性休克死亡率>80%。
注:選擇設備需權衡精度需求、侵入性風險及臨床場景,動態監測趨勢比單次絕對值更具價值。
注:文章來源于網絡,如有侵權,請聯系刪除





 全部商品分類
全部商品分類